화학의 기초: 물리로 설명하는 주기율표와 원자 및 분자의 세계
이 강의는 원소들이 무엇이고, 어떻게 구분되고, 왜 다른 성질을 가지는지 이해하고자 하는 강의로 총 3편으로 구성된다. 강의 1에서는 원소기호 이해하기, 강의 2는 주기율표 상의 모든 원소의 성질 이해하기, 강의 3은 원소들과의 결합, 즉 분자에 대해 이해하고자 한다.
강의 2: 주기율표 이해하기
우리는 강의 1에서 원소 기호에 붙어있는 원자 번호, 질량수, 원자량을 이해하기 위해, 입자들에 대해서 자세히 알아보고 상호작용까지 알아보았습니다. 중학교 과학이라고, 대충 넘어가지 않고 최대한 깊이 들어가 보았습니다. 각 원소들, 특히 동위원소별 원자량과 질량수를 알면, 핵융합이나 핵분열 시 질량 결손이 발생하여 큰 에너지를 얻어내는 과정을 이해할 수 있습니다.
오늘은 주기율표에 대해 공부해 보겠습니다. 주기율표에는 118개의 원소들이 배열되어 있습니다. 왜 118개일까요? 118개 넘는 양성자를 가진 원소는 불가능할까요? 아닙니다. 단지 매우 불안정해서 만들자마자 바로 붕괴되기 때문입니다. 118개 보다 더 많은 양성자를 중성자와 함께 안정적으로 한 핵에 담을 수 없는 이유가 강력에 있습니다. 우리는 이 기본 원리를 배웠고, 비록 118개 넘는 원소를 만들 수 없는 이유를 정확히 계산할 수는 없지만, 그 이유가 강력에 있다는 것을 이해하는 것만으로도 자연에 대해 많은 이해를 가진 것입니다.
1. 전자껍질과 원소당 전자의 배치
자세한 주기율표의 원소에 들어가기 전에, 우주에 존재하는 모든 원소는 118개라는 사실을 염두에 두고, 우선 전자 껍질에 대해 알아봅시다.
전자 껍질이란?
먼저 전자 껍질에 대해 알아야 할 몇 가지 정보가 있습니다. 사실 전자는 태양 주변을 도는 행성처럼 핵 주변을 도는 것이 아니라, 핵을 중심으로 하는 전자 껍질에 존재합니다. 이는 전자가 특정 궤도를 따라 도는 것이 아니라, 확률적으로 그 위치에 존재함을 의미합니다. 전자 껍질에 전자가 있을 확률이 매우 높고, 전자 껍질을 벗어나면서 존재 확률이 급속도로 낮아집니다. 전자껍질의 개념은 보어의 원자 모형에서 비롯되었습니다. 보어는 전자가 특정한 에너지를 가진 궤도에서만 존재할 수 있다고 제안했습니다. 이러한 궤도들은 에너지 준위로도 알려져 있으며, 전자가 한 에너지 준위에서 다른 에너지 준위로 이동할 때 에너지를 흡수하거나 방출하게 됩니다.
전자껍질은 각기 다른 에너지 준위를 가진 여러 껍질로 구성됩니다. 가장 안쪽부터 순서대로 K, L, M, N, O, P, Q 껍질로 불리며, 각 껍질은 최대한 채울 수 있는 전자의 수가 정해져 있습니다. 예를 들어, 첫 번째 껍질(K껍질)은 최대 2개의 전자를 가질 수 있고, 두 번째 껍질(L껍질)은 최대 8개의 전자를 가질 수 있습니다. 이 숫자는 각 껍질의 전자 수용 능력을 나타내며, 이는 원소의 화학적 성질에 큰 영향을 미칩니다.
만약 전자가 행성처럼 핵 주위를 돌게 되면, 일반물리를 적용하면, 가속도에 의해 전자의 에너지가 빛을 방출하면서 낮아져 결국 핵과 융합해야 하는데, 실제로는 그렇지 않고 매우 안정적으로 존재합니다. 이는 전자 껍질이 전자기 상호작용에 대한 양자역학 방정식의 해로 설명되기 때문입니다. 즉 일반 물리가 아니라, 양자역학의 해로 이해해야 하는 미시의 세계가 원자의 세계인거죠. 하지만 일반적으로 얘기할때에는 전자가 핵 주변을 돈다 이렇게 표현해도 알아 들을때에는 전자껍질에 존재한다 이렇게 생각하시면 됩니다.
양자수와 전자 배치
전자껍질에 있는 전자들은 특정한 에너지값을 가지며, 이를 에너지 준위라고 부릅니다. 이 에너지 준위는 연속적이지 않고, 비연속적인 값으로 존재합니다. 예를 들어, 수소 원자의 경우 가장 낮은 에너지값은 -13.6eV입니다. 양성자가 많은 다전자 원소들의 경우, 에너지값은 양성자 수의 제곱에 비례하여 증가하지만 (사실은 에너지값이 음수라 더 낮아집니다.), 실제로는 전자들 간의 반발력과 차폐 효과 때문에 에너지 준위가 달라집니다. 이런 상호작용으로 인해 다전자 원소의 에너지값은 단순히 양성자 수만으로 예측할 수 없습니다. 중학생입장에서는 에너지값의 단위에 대해 신경쓰지 마시고, 이 값의 의미를 자유롭게 진공에 존재하는 자유전자가 핵에 포획되면, 13.6eV의 에너지를 내어 놓으며 (이 에너지에 해당하는 빛을 방출하며), 낮은 에너지 상태인 n=1 (K 껍질)로 들어간다라고 생각하면 됩니다. 다시 설명하지만, 자유전자의 운동에너지를 생각하지 않으면, 자유전자의 에너지는 0 입니다. 그래서 이 전자가 핵에 붙잡여서 n = 1 에너지 준위로 떨어지면, 에너지를 방출하게 되고, 결국 -13.6eV 즉 마이너스 에너지 상태로 떨어져서, 다시 에너지를 받지 않는 한, 안정한 상태를 유지하게 됩니다.
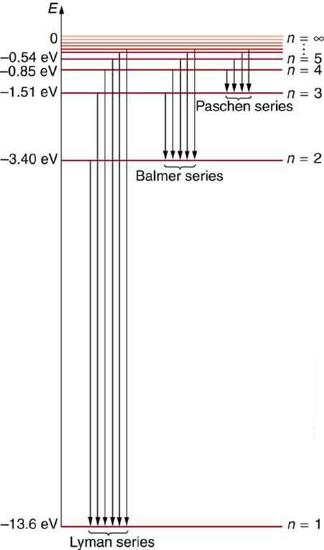
주양자수 (n)
수소를 기준으로 보면, n = 1, 2, 3 등의 순으로 같은 에너지 준위를 가지는 전자 껍질이 배치됩니다. 숫자로 표기하지 않고 알파벳으로 표기시에는 위에 잠깐 언급한대로 K,L, M, O, P, Q, R 껍질이라고 합니다. 이때 n을 주양자수라고 합니다. 주양자수 n에 따라 배치될 수 있는 전자의 수는 다음과 같은 공식으로 계산할 수 있습니다: 2n2 , 이 공식을 꼭 외워두세요! 같은 에너지준위에, 이 수만큼의 전자가 들어 갈 수가 있습니다.
예시:
- n = 1일 때 전자 수 = 2×1 = 2
- n = 2일 때 전자 수 = 2×4 = 8
- n = 3일 때 전자 수 = 2×9 = 18
부양자수 (l)
주양자수 n이 1일때, 1개의 전자껍질이 있습니다. 저 공식의 2는 한 껍질에 전자가 2개만 들어갈 수 있다는 걸 말합니다. n이 2인 경우, 다른 형태의 전자껍질이 4개가 존재하고, 각 껍질에 2개씩 그래서 총합이 8개의 전자가 들어갈 수 있슴을 의미합니다. 자 여기서 부양자수는 ㅣ = 0, …, n-1 까지 가능합니다. 즉 n=1의 껍질에는 l = 0의 껍질이 존재하고, n =2 일때에는 l = 0, 1 이런 식으로 l 값이 하나씩 늘어갑니다.
부양자수는 전자의 궤도를 설명하며, l의 숫자대신 각각 s, p, d, f 등 오비탈(orbital)이라고 부릅니다. 즉 같은 에너지준위에 다른 형태의 전자껍질을 구분하기 위해, 부양자수를 사용한다. s 오비탈은 1개의 전자껍질, p는 3종류의 전자껍질, d는 5종류의 전자껍질, f는 7종류의 전자껍질이 존재하며, 각 전자껍질의 모양은 아래 그림에 있습니다.
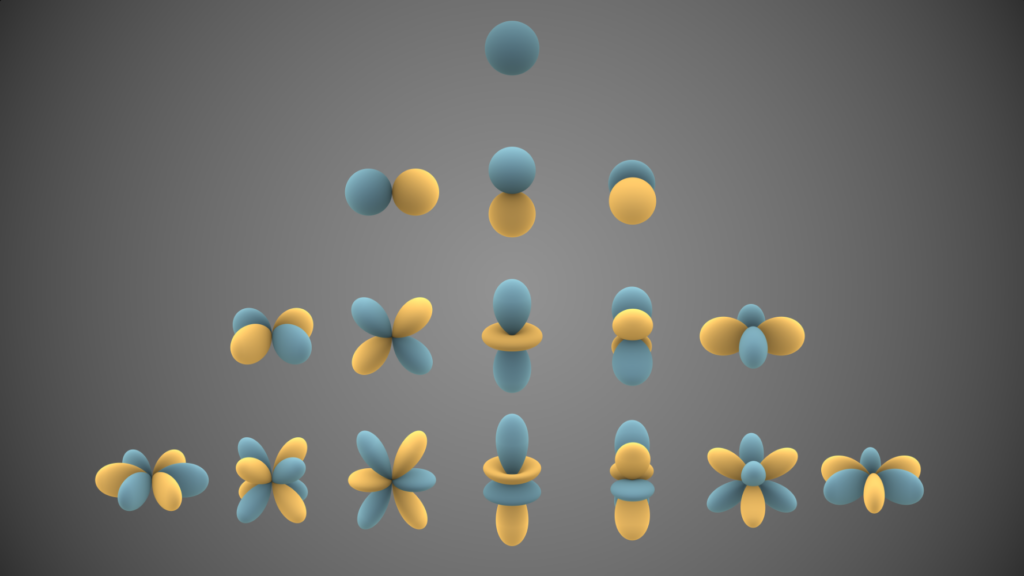
위 4줄의 그림은 위에서 부터 아래로, s, p, d, f 오비탈의 모양을 나타냅니다.
다시 정리해 보겠습니다.
전자 껍질 구조
주양자수는 같은 에너지 준위를 가진 전자들의 집단인데, 주양자수가 커질수록 전자 껍질은 원자핵에서 멀어집니다. 같은 주양자수 내에서도 간단한 원형 궤도부터 시작하여 주양자수가 커질수록 더 복잡한 궤도가 생기는데, 이를 부양자수라고 합니다.
파울리 배타 원리
가장 중요한 것은, 같은 주양자수 n에 따라 각 오비탈마다 2개의 전자만 배치할 수 있다는 것입니다. 이는 파울리 배타 원리에 의해 설명됩니다. 파울리 배타 원리는 전자와 같은 입자들은 같은 상태(양자역학의 해)에 하나만 배치할 수 있다는 원리입니다.
예시:
공식 2n2 에서 앞에 2가 곱해져 있느냐 하면, 전자가 스핀이라는 특성을 가지고 있기 때문입니다. 전자는 업스핀과 다운스핀을 가지며, 같은 오비탈에 업스핀 전자 하나와 다운스핀 전자 하나가 배치될 수 있습니다. 이는 같은 상태의 전자가 아닌 것이죠. 스핀값이 달라서 같은 오비탈에 배치할 수 있는 것입니다.
이제 좀 더 쉽게 이해할 수 있겠죠? 전자 껍질에 대해 좀 더 깊이 공부하고, 주기율표의 원소들에 대해 알아보도록 합시다!
전자껍질과 오비탈의 기본 개념
1. 주 양자수(n)
주 양자수는 전자껍질을 나타내며, n이 커질수록 전자껍질은 원자핵에서 멀어집니다.
2. 부 양자수(l)
부 양자수는 오비탈의 형태를 나타내며, l 값에 따라 다음과 같이 오비탈이 나뉩니다:
- l=0: s 오비탈 (구형, 1개)
- l=1: p 오비탈 (덤벨형, 3개)
- l=2: d 오비탈 (복잡한 모양, 5개)
- l=3: f 오비탈 (더 복잡한 모양, 7개)
각 그림 한줄 한줄을 n x 오비탈로 나타내면, 위에서 아래로 1s, 2p, 3d, 4f의 오비탈의 모양입니다.
그러니까, 2s의 모양은, 주 양자수 2, 부양자수 0, 이니까 s형태의 오비탈인데, 1s의 오비탈과 같은 구형이지만, 조금 더 복잡한 형태입니다. 즉 같은 오비탈이더라도 주양자수가 다르면, 실제 모양은 다르다. 하지만 외곽 모양은 거의 유사하다라고 생각하시면 됩니다.
다음 각 껍질당 전자가 배치되는 것을 주기와 함께 공부해 보겠습니다.
3d라고 표현하면, 주양자수 3 이면서, 부양자수 2임을 의미합니다.
2. 주기율표의 주기에 대한 이해
각 껍질당 최대 전자 수 공식
전자껍질에 들어갈 수 있는 최대 전자 수는 다음 공식으로 계산됩니다: 2n2 여기서 n은 주 양자수입니다. 이 공식을 통해 각 껍질일당 최대 전자수를 구할 수 있습니다.
전자껍질과 부양자수
- 주기 (Period): 주기율표에서 가로줄을 나타내며, 주 양자수(n)에 해당합니다.
- 1주기: n=1
- 2주기: n=2
- 3주기: n=3
- 4주기: n=4
- 5주기: n=5
- 6주기: n=6
- 7주기: n=7
- 부양자수 (Azimuthal Quantum Number, l): 오비탈의 형태를 나타내며, l 값에 따라 s, p, d, f 오비탈로 나뉩니다.
- l=0: s 오비탈
- l=1: p 오비탈
- l=2: d 오비탈
- l=3: f 오비탈
오비탈 채움 순서
이러한 전자 배치 규칙은 다전자 원자의 경우에도 적용됩니다. 다전자 원자에서는 전자 간 반발과 차폐 효과로 인해 오비탈의 에너지가 달라질 수 있지만, 전자 배치는 항상 가장 낮은 에너지 상태를 우선으로 합니다.
전자가 오비탈에 채워지는 순서는 다음과 같습니다: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p
다원자 원소의 각 주기는 그래서 원형 오비탈 즉 1s, 2s, 3s, …, 7s까지의 기준으로 각 주기가 시작됩니다.
실제 오비탈의 에너지는 단순한 전자껍질의 모양이 다전자 원소에서 낮은 에너지준위를 가진다. 그래서 주양자수 순서대로, 그래서 주양자수 기준으로, 부양자수 순으로 에너지준위가 높아질 뿐만 아니라, 부양자수 s, p 형태가 더 낮은 에너지준위를 가지게 되어, 위의 오비탈에 채워지는 순위가 달라진다. 위의 오비탈에 전자가 채워지는 순서가 실제 다전자 원소의 에너지준위 순입니다.
위의 채워지는 순서에 s 오비탈을 만날때마다 새로운 주기가 시작되어, 7개의 주기가 완성된다. 저 순서대로 원자번호가 부여되어 있습니다.
각 주기의 실제 오비탈 구성
- 1주기: 1s (2개의 전자)
- 2주기: 2s (2개의 전자), 2p (6개의 전자)
- 3주기: 3s (2개의 전자), 3p (6개의 전자)
- 4주기: 4s (2개의 전자), 3d (10개의 전자), 4p (6개의 전자)
- 5주기: 5s (2개의 전자), 4d (10개의 전자), 5p (6개의 전자)
- 6주기: 6s (2개의 전자), 4f (14개의 전자), 5d (10개의 전자), 6p (6개의 전자)
- 7주기: 7s (2개의 전자), 5f (14개의 전자), 6d (10개의 전자), 7p (6개의 전자)
예시: 원소의 전자 배치
- 수소 (H, 원자번호 1): 1s¹
- 헬륨 (He, 원자번호 2): 1s²
- 리튬 (Li, 원자번호 3): 1s² 2s¹
- 베릴륨 (Be, 원자번호 4): 1s² 2s²
- 붕소 (B, 원자번호 5): 1s² 2s² 2p¹
전자 배치 표기 1s2 2s1
이 표기는 리튬 원자의 전자가 어떻게 배치되어 있는지를 나타냅니다. 각 숫자와 문자는 특정한 의미를 가집니다.
- 1s²: 여기서 ‘1’은 주양자수(n)입니다. 주양자수 1은 첫 번째 전자 껍질을 의미합니다. ‘s’는 부양자수(l)를 나타내며, s 오비탈을 의미합니다. ‘²’는 s 오비탈에 있는 전자 수를 의미합니다. 따라서 ‘1s²’는 첫 번째 전자 껍질의 s 오비탈에 전자 2개가 있음을 나타냅니다.
- 2s¹: 여기서 ‘2’는 주양자수(n)로, 두 번째 전자 껍질을 의미합니다. ‘s’는 부양자수(l)로, s 오비탈을 의미합니다. ‘¹’는 s 오비탈에 있는 전자 수를 나타냅니다. 따라서 ‘2s¹’는 두 번째 전자 껍질의 s 오비탈에 전자 1개가 있음을 나타냅니다.
118개의 원소와 전자껍질
현재 발견된 118개의 원소들은 7주기까지 채워져 있으며, 7주기까지의 모든 s, p, d, f 오비탈이 포함됩니다. 이는 주기율표의 마지막 원소인 오가네손(Oganesson, Og, 원자번호 118)이 7p 오비탈에 전자를 가지고 있음을 의미합니다.
참고 자료
3. 주기율표 상의 족(group)에 대한 이해
우리는 앞에서 과학자들이 118개의 원소들을 주기로 구분한 방법을 이해했습니다. 사실 주기가 높아지는 것은 양성자 수가 많아지고, 그에 따라 중성자 수가 많아지는 것 외에는 큰 의미가 없습니다. 단지 점점 무거워진다는 것이죠.
전자 껍질과 주양자수
전자가 차곡차곡 맨 아래의 전자 껍질부터 채워지면, 즉 주양자수가 많아질수록 전자는 원자핵으로부터 멀어집니다. 그래서 원소들 간의 영향은 가장 원자핵으로부터 멀리 있는 전자들에 의해 결정됩니다. 그래서 제일 바깥에 있는 전자들을 최외곽전자라고 합니다. 즉, 원소들의 화학적인 성질은 최외곽 전자들에 의해 결정됩니다.
전자 껍질의 모양과 화학적 성질
위의 그림에서 보면, 부양자수가 달라지면서 전자 껍질의 모양이 많이 복잡해집니다. 전자 껍질의 모양이 바로 전자가 실제 존재하는 곳이며, 이런 모양이 원자들끼리 서로 상호작용하는 데 큰 영향을 줍니다. 따라서 화학적인 성질은 최외곽 전자의 부양자수(l)가 무엇인지, 즉 s, p, d, f의 여부, 그리고 최외곽 전자의 수에 크게 영향을 받습니다.
주기 (Period)
주기는 주기율표에서 가로 줄을 의미합니다. 각 주기는 원소들이 전자껍질의 수가 증가함에 따라 배열됩니다. 주기 수는 해당 원소의 가장 바깥쪽 전자껍질의 주 양자수(n)를 나타냅니다. 예를 들어, 주기 1에는 n=1인 원소들, 주기 2에는 n=2인 원소들이 위치합니다.
- 특징:
- 같은 주기에 있는 원소들은 같은 주양자수의 전자껍질을 가집니다. s와 p 만
- 주기가 증가할수록 원자 반지름과 에너지가 증가(0의 값에 가까워진다는 의미)합니다.
- 주기 내에서 왼쪽에서 오른쪽으로 갈수록 원자 번호와 원자 질량이 증가합니다.
예시:
- 1주기: 수소(H), 헬륨(He)
- 2주기: 리튬(Li), 베릴륨(Be), 붕소(B), 탄소(C), 질소(N), 산소(O), 플루오린(F), 네온(Ne)
족 (Group)
족은 주기율표에서 세로 줄을 의미하며, 같은 족에 있는 원소들은 비슷한 화학적 성질을 가집니다. 족 수는 주로 원소의 최외각 전자껍질에 있는 전자의 수와 관련이 있습니다. 같은 족에 속한 원소들은 동일한 수의 최외각 전자를 가지므로, 화학적 성질이 유사합니다.
- 특징:
- 같은 족에 있는 원소들은 비슷한 화학적 성질과 반응성을 가집니다.
- 족 번호가 커질수록 원자 번호와 원자 질량이 증가합니다.
예시:
- 1족 (알칼리 금속): 수소(H), 리튬(Li), 나트륨(Na), 칼륨(K)
- 17족 (할로젠): 플루오린(F), 염소(Cl), 브로민(Br), 요오드(I)
- 18족 (귀족 기체): 헬륨(He), 네온(Ne), 아르곤(Ar), 크립톤(Kr), 제논(Xe), 라돈(Rn)
주기와 족의 관계
주기와 족의 관계는 원소들의 전자 배치에 의해 결정됩니다. 같은 주기에 있는 원소들은 같은 주양자수의 전자껍질을 가지지만(4주기부터 사실은 틀립니다. 앞의 설명 참조), 최외각 전자의 수는 다릅니다. 반면, 같은 족에 있는 원소들은 같은 수의 최외각 전자를 가지지만, 전자껍질의 수는 다릅니다.
예를 들어, 2주기 원소들의 전자 배치는 다음과 같습니다:
- 리튬(Li): 1s² 2s¹
- 베릴륨(Be): 1s² 2s²
- 붕소(B): 1s² 2s² 2p¹
한편, 1족 원소들의 전자 배치는 다음과 같습니다:
- 수소(H): 1s¹
- 리튬(Li): 1s² 2s¹
- 나트륨(Na): 1s² 2s² 2p⁶ 3s¹
자 1족을 보게 되면 모두 주양자수는 달라도 모두 s1 로 최외곽 전자가 동일합니다. s2 는 s 오비탈에 2개의 전자가 모두 들어있다는 거죠.
3. 주기율표 관찰하기
아래의 주기율표는 https://www.rsc.org/periodic-table 에서 가져왔습니다.
최외곽전자가 s 오비탈인 경우
최외곽전자가 p 오비탈인 경우
최외곽전자가 d 오비탈인 경우
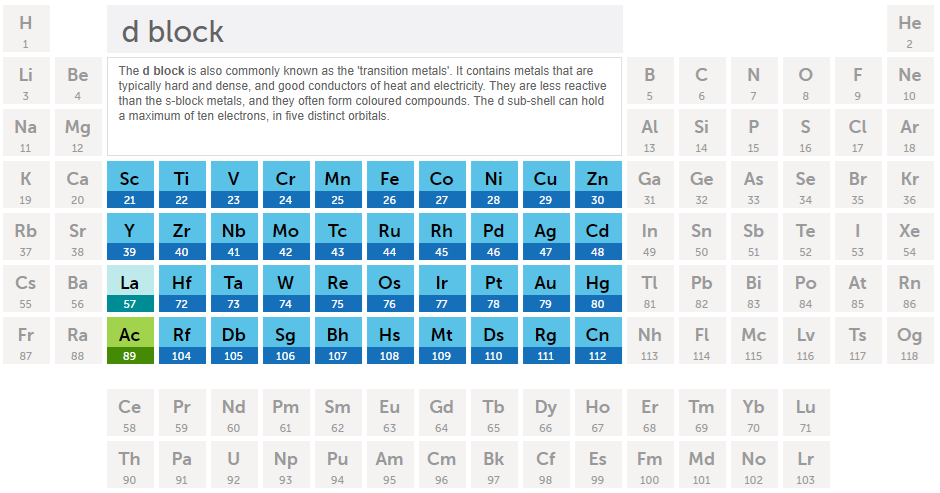
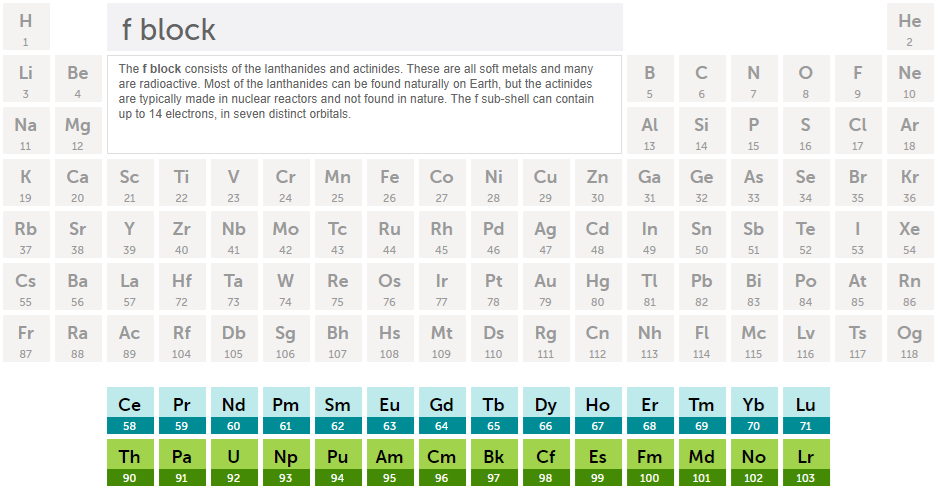
최외곽전자가 f 오비탈인 경우
4. 주기율표와 최외곽 전자에 따른 원소의 성질
주기율표에서 원소들의 성질은 주로 최외곽 전자, 즉 가장 바깥쪽 전자 껍질에 있는 전자들에 의해 결정됩니다. 이 최외곽 전자들은 화학 반응에서 중요한 역할을 하며, 원소들의 화학적 성질과 물리적 성질을 좌우합니다. 이는 주로 전자를 잃거나 얻는 경향에 따라 달라집니다.
전자를 잃는 원소 (양이온 형성)
- 알칼리 금속 (1족):
- 예: 리튬(Li), 나트륨(Na), 칼륨(K)
- 최외곽 전자 수: 1개 (ns¹)
- 성질: 최외곽 전자를 하나 잃어 양이온(+)이 되기 쉽습니다. 예를 들어, 나트륨(Na)은 전자를 하나 잃고 Na+ 이온이 됩니다.
- 이유: 전자를 잃으면 안정적인 전자 배치를 형성하여 에너지를 낮춥니다. 예: Na는 전자를 하나 잃어 네온(Ne)과 같은 안정한 전자 배치를 가집니다.
- 알칼리 토금속 (2족):
- 예: 베릴륨(Be), 마그네슘(Mg), 칼슘(Ca)
- 최외곽 전자 수: 2개 (ns²)
- 성질: 최외곽 전자 2개를 잃어 양이온(2+)이 되기 쉽습니다. 예: 마그네슘(Mg)은 전자를 두 개 잃고 Mg2+ 이온이 됩니다.
- 이유: 두 전자를 잃어 안정적인 전자 배치를 형성합니다. Mg는 전자를 두 개 잃어 네온(Ne)과 같은 전자 배치를 가집니다.
- 전이 금속 (3-12족):
- 예: 철(Fe), 구리(Cu), 금(Au)
- 최외곽 전자 수: 다양 (d 오비탈에 전자 존재)
- 성질: 다양한 산화 상태를 가질 수 있으며, 촉매로 작용하거나 합금을 형성하기 쉽습니다. 대부분이 높은 밀도와 강도를 가집니다.
- 이유: 전이 금속들은 d 오비탈에 있는 전자들이 화학 반응에 참여할 수 있어 다양한 성질을 보입니다. 예를 들어, 철(Fe)은 +2와 +3의 산화 상태를 가질 수 있습니다.
전자를 얻는 원소 (음이온 형성)
- 할로겐 (17족):
- 예: 플루오린(F), 염소(Cl), 브로민(Br)
- 최외곽 전자 수: 7개 (ns² np⁵)
- 성질: 전자를 하나 얻어 음이온(−)이 되기 쉽습니다. 예: 염소(Cl)는 전자를 하나 얻어 Cl− 이온이 됩니다.
- 이유: 전자를 하나 얻어 안정적인 전자 배치를 형성합니다. Cl는 전자를 하나 얻어 아르곤(Ar)과 같은 전자 배치를 가집니다.
- 산소족 (16족):
- 예: 산소(O), 황(S), 셀레늄(Se)
- 최외곽 전자 수: 6개 (ns² np⁴)
- 성질: 전자를 두 개 얻어 음이온(2−)이 되기 쉽습니다. 예: 산소(O)는 전자를 두 개 얻어 O2− 이온이 됩니다.
- 이유: 전자를 두 개 얻어 안정적인 전자 배치를 형성합니다. O는 전자를 두 개 얻어 네온(Ne)과 같은 전자 배치를 가집니다.
- 질소족 (15족):
- 예: 질소(N), 인(P), 비소(As)
- 최외곽 전자 수: 5개 (ns² np³)
- 성질: 전자를 세 개 얻어 음이온(3−)이 되기 쉽습니다. 예: 질소(N)는 전자를 세 개 얻어 N3− 이온이 됩니다.
- 이유: 전자를 세 개 얻어 안정적인 전자 배치를 형성합니다. N은 전자를 세 개 얻어 네온(Ne)과 같은 전자 배치를 가집니다.
안정된 원소 (비활성 기체)
- 비활성 기체 (18족):
- 예: 헬륨(He), 네온(Ne), 아르곤(Ar)
- 최외곽 전자 수: 완전한 전자 껍질 (ns² np⁶)
- 성질: 매우 안정적이며, 다른 원소들과 거의 반응하지 않습니다. 이는 이미 안정적인 전자 배치를 가지고 있기 때문입니다.
기타 족의 원소들
- 붕소족 (13족):
- 예: 붕소(B), 알루미늄(Al), 갈륨(Ga)
- 최외곽 전자 수: 3개 (ns² np¹)
- 성질: 전자를 3개 잃어 3가 양이온이 되기 쉽습니다. 예: 알루미늄(Al)은 전자를 3개 잃고 Al3+ 이온이 됩니다.
- 이유: 전자를 3개 잃어 안정적인 전자 배치를 형성합니다.
- 탄소족 (14족):
- 예: 탄소(C), 규소(Si), 주석(Sn)
- 최외곽 전자 수: 4개 (ns² np²)
- 성질: 4가 공유 결합을 형성하기 쉽습니다. 예: 탄소(C)는 네 개의 공유 결합을 형성하여 다양한 유기 화합물을 만듭니다.
- 이유: 전자를 4개 잃거나 얻기보다는 공유 결합을 통해 전자 쌍을 형성하여 안정적인 배치를 이루기 때문입니다.
옥텟 규칙 (Octet Rule)
원소들이 전자를 잃거나 얻으려는 이유 중 하나는 옥텟 규칙 때문입니다. 옥텟 규칙에 따르면, 원자들은 안정적인 전자 배치를 이루기 위해 최외곽 전자 껍질에 8개의 전자를 채우려 합니다. 이는 18족 비활성 기체들이 매우 안정적인 이유입니다.
예시:
- 나트륨(Na): 최외곽 전자 1개를 잃어 Na+ 이온이 되어 네온(Ne)과 같은 안정적인 전자 배치를 가집니다.
- 염소(Cl): 최외곽 전자 1개를 얻어 Cl− 이온이 되어 아르곤(Ar)과 같은 안정적인 전자 배치를 가집니다.
이 정보를 통해 주기율표상의 원소들이 전자를 얻거나 잃으려는 경향을 더 잘 이해할 수 있을 것입니다. 이 경향은 원소들의 화학적 반응성과 성질을 결정하는 중요한 요인입니다.
118개의 원소들 중에서 대부분은 금속입니다. 아래는 비금속 및 준금속만 표시했습니다.
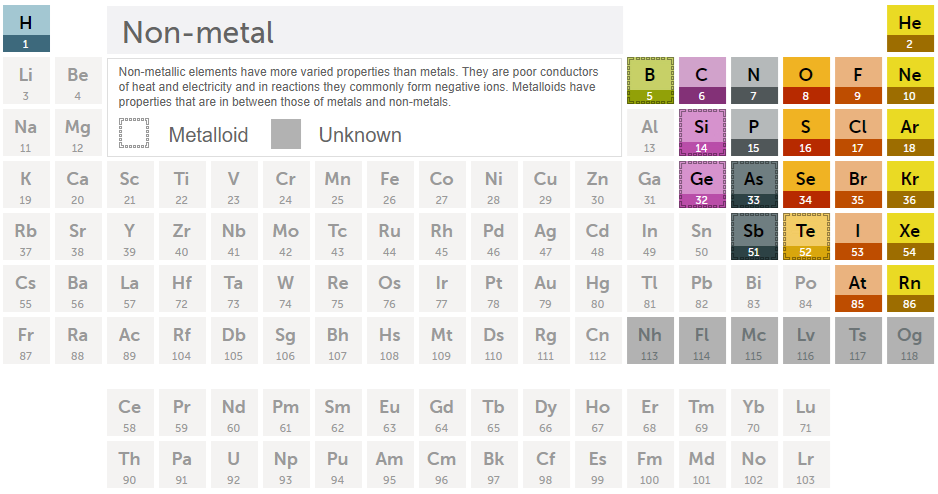
그리고 금속에도 속하고, 비금속에도 속하는 원소를 준금속이라고 한다.
준금속이란?
준금속(Metalloids)은 금속과 비금속의 성질을 모두 가지는 원소들입니다. 주기율표에서 금속과 비금속의 경계에 위치하며, 다양한 물리적 및 화학적 성질을 가지고 있습니다.
준금속의 특징
- 반도체 성질:
- 준금속은 온도에 따라 전기 전도성이 달라져 반도체로 사용됩니다.
- 예: 실리콘(Si), 게르마늄(Ge)
- 물리적 성질:
- 금속처럼 광택이 나지만, 비금속처럼 부서지기 쉽습니다.
- 예: 붕소(B)
- 화학적 성질:
- 금속처럼 양이온이 되거나 비금속처럼 음이온이 될 수 있습니다.
- 예: 실리콘(Si)은 전자 4개를 공유합니다.
주기율표에서 준금속의 위치
주기율표에서 준금속은 금속과 비금속의 경계에 대각선으로 배열되어 있습니다. 대표적인 준금속은 다음과 같습니다:
- 붕소(B)
- 실리콘(Si)
- 게르마늄(Ge)
- 비소(As)
- 안티모니(Sb)
- 텔루륨(Te)
준금속의 예와 용도
- 실리콘(Si):
- 용도: 컴퓨터 칩, 태양 전지, 유리.
- 게르마늄(Ge):
- 용도: 광섬유, 트랜지스터, 다이오드.
- 붕소(B):
- 용도: 내열 유리, 세라믹.
- 안티모니(Sb):
- 용도: 합금, 반도체 장치.
- 비소(As):
- 용도: 살충제, 반도체 도핑.
요약
- 준금속은 금속과 비금속의 성질을 모두 가지며, 주기율표에서 경계에 위치한 원소들입니다.
- 이들은 반도체로서 중요한 역할을 하며, 다양한 산업에서 사용됩니다.
우리는 전자껍질에 대해 이해함으로써, 118개의 원소들이 어떤 성질을 가지고 있지 대략이나마 확인할 수 있었습니다. 그리고 전자를 잃고 이온이 된 경우, 즉 양이온은 원소의 크기가 왜 작아지는지도 이해할 수 있을 겁니다. 특히 1, 2족의 경우는 주양자수가 작아지니까요. 다음 시간에는 이런 외곽전자의 배치에 의해, 원소들끼리 어떻게 결합해서, 많은 분자들을 이루는지 알아보겠습니다.
